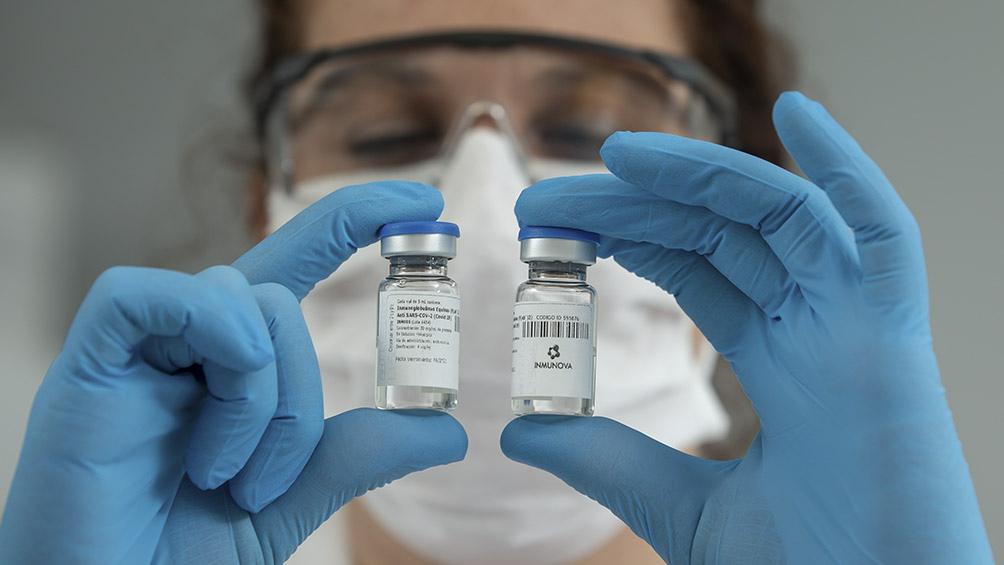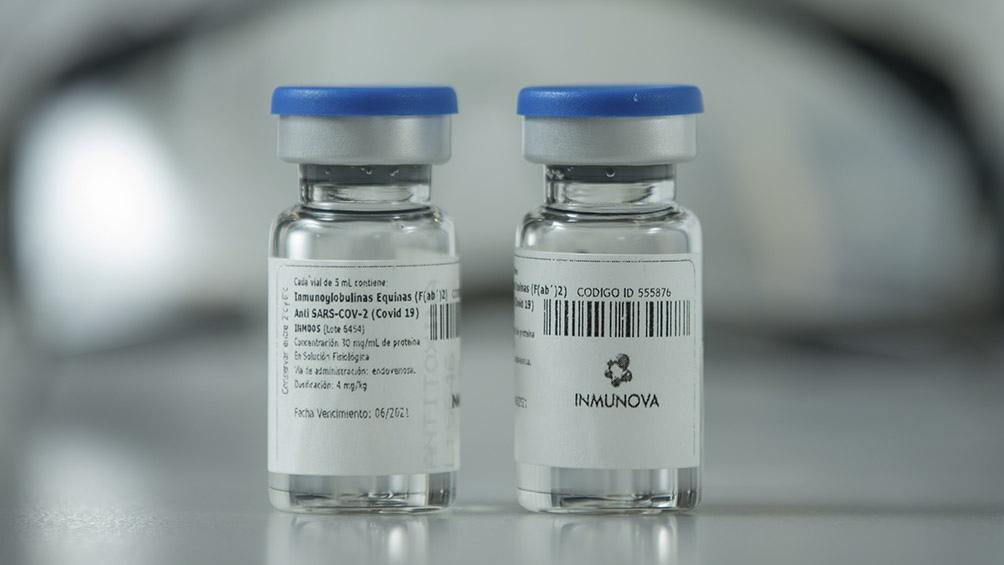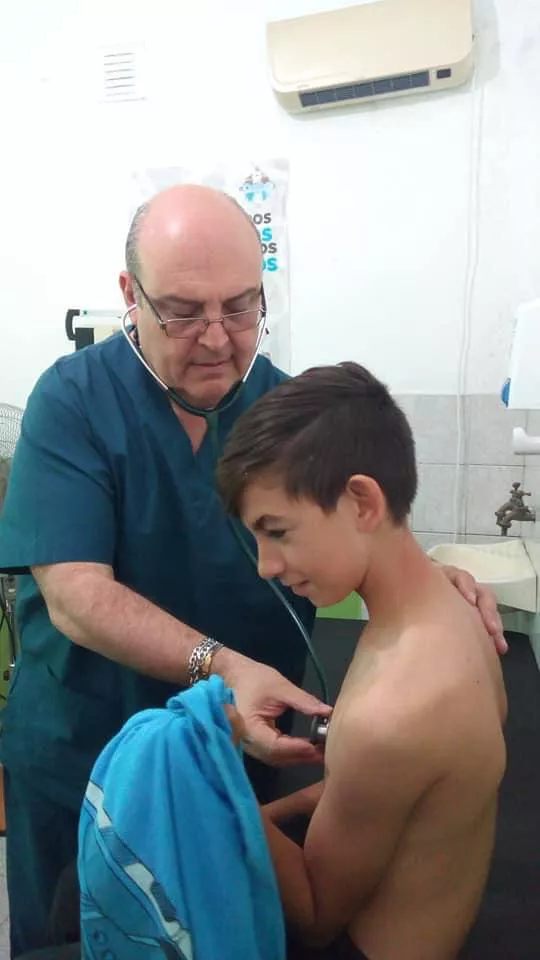
Arfus: “El panorama es similar en todos lados; tenemos un aumento de contagios y Cañuelas no es una isla”
El secretario de Salud no esquivó la coyuntura que se vive a nivel nacional y, por supuesto, pega en el ámbito local. En la charla con El Ciudadano, el médico enfatizó: “Hay un alto índice de vacunación, por arriba del 95%, y eso es muy importante”.